Do que são feitas as bolhas quando a água ferve?
A agua ferve quando a energia do calor é grande o suficiente para quebrar as ligações de hidrogênio entre as moléculas de água. O gás que é liberado da água fervente é composto de oxigênio e dióxido de carbono.
Se você já ferveu água, deve ter notado que, à medida que a água aquece, formam-se bolhas muito pequenas que sobem de baixo para cima. Inicialmente, as bolhas são poucas e esparsas, mas à medida que a água fica mais quente, mais bolhas de tamanhos maiores começam a se formar. Aumentar ainda mais o calor resulta em bolhas ainda maiores que se formam com bastante frequência e sobem imediatamente para o topo. Essa escalada atinge um pico quando a água começa a ferver.
Mas por que a água fervente faz bolhas?
A resposta para isso tem a ver com a química da própria água. Mais especificamente, tem a ver com todas as substâncias dissolvidas na água, bem como a natureza da ligação entre as moléculas de água.
Propriedades Químicas das Moléculas de Água
Cada molécula de água é composta por dois átomos de hidrogênio (H) e um átomo de oxigênio (O). Ambos os átomos de H estão ligados covalentemente ao único átomo de O. Cada elemento na natureza se esforça para alcançar um estado de energia mais baixa possível. Este estado é alcançado perdendo ou ganhando elétrons para alcançar a configuração de gás nobre mais próxima.
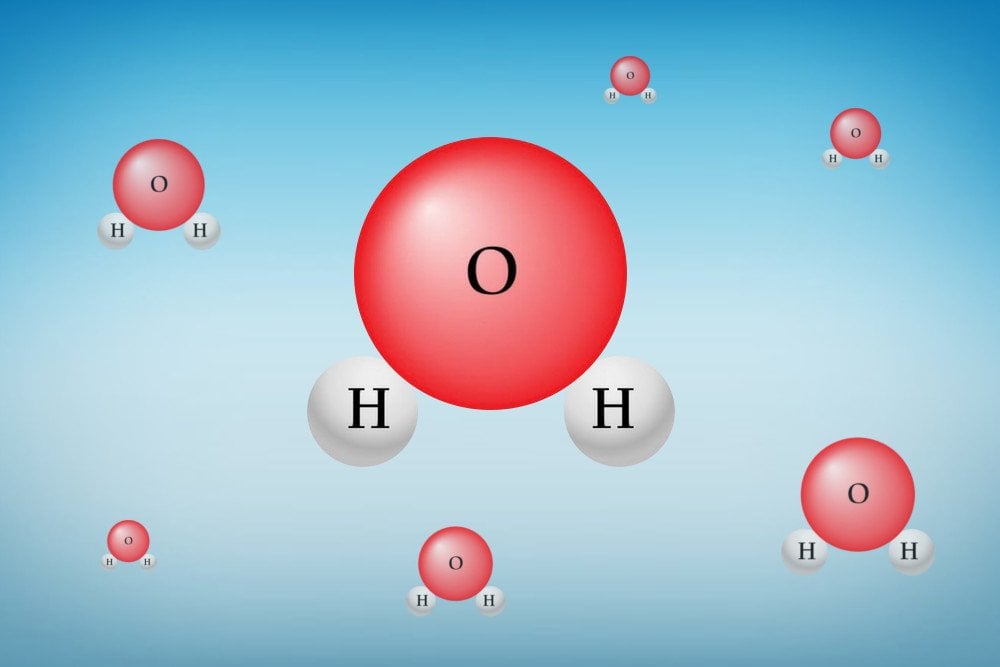
Ilustração de uma molécula de água
Um átomo de oxigênio tem seis elétrons em sua camada de valência (mais externa). O gás nobre mais próximo, Neon, tem oito elétrons em sua camada de valência. Assim, O tem uma forte tendência a ganhar dois elétrons e atingir uma configuração eletrônica estável (entrar no estado de energia mais baixo). Um hidrogênio tem um elétron em sua camada de valência, enquanto o gás nobre mais próximo, o hélio, tem dois elétrons em sua camada de valência. Assim, H tende a ganhar um elétron para atingir uma configuração eletrônica estável.
Ambos os átomos de H compartilham um elétron cada um com O, enquanto O compartilha dois elétrons, um para cada H. Esta é uma ligação covalente. O oxigênio tem uma forte tendência a atrair elétrons compartilhados para si, devido a uma propriedade chamadaeletronegatividade. Assim, os elétrons passam mais tempo perto do átomo de O do que do átomo de H, resultando em uma carga parcial negativa no O e uma carga parcial positiva no H.
A geometria de uma molécula de água é tal que as cargas não se cancelam e há uma separação dos centros de carga (polarização). Quando duas moléculas de água com ligeira polarização se aproximam, o O parcialmente negativo de uma molécula atrai o H parcialmente positivo da outra molécula para formar uma ligação intermolecular fraca. Isso é chamado deligação de hidrogênioe é a força responsável por manter as moléculas de água juntas.
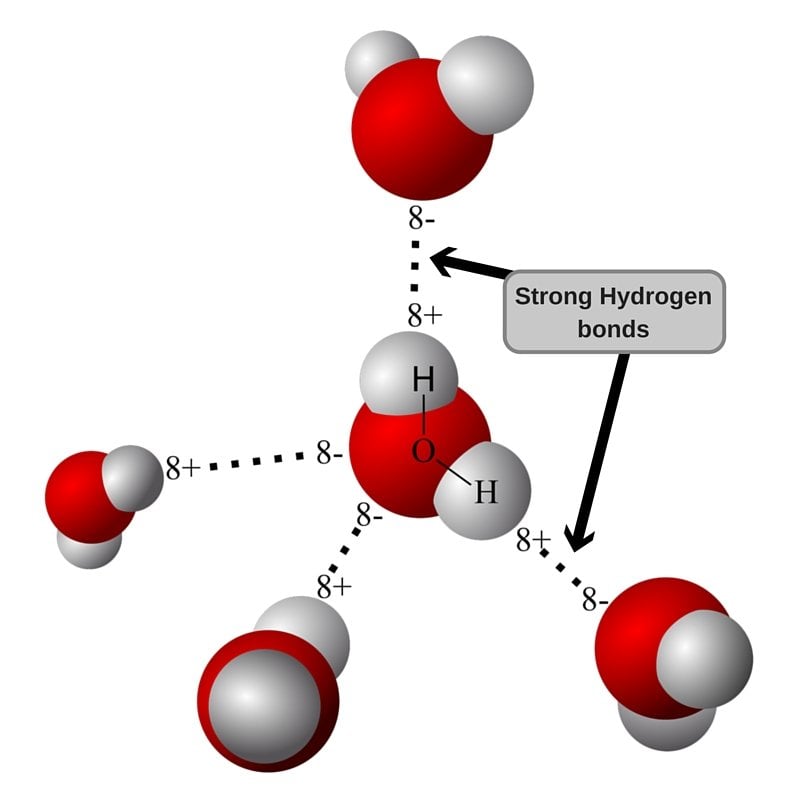
Ligação de hidrogênio visualizada.
Como a ligação de hidrogênio é fraca, a água permanece líquida à temperatura ambiente e, à medida que a temperatura aumenta, as moléculas ganham mais energia para superar as ligações de hidrogênio intermoleculares.A 100oC, a energia é suficiente para que as moléculas se libertem.
Substâncias dissolvidas na água
A dissolução de uma substância em outra só é possível quando há interação entre as moléculas das duas substâncias. Da mesma forma, alguns gases, por exemplo, O2, CO2, N2, NH3e SO2,são dissolvidos em água porque existe alguma interação atrativa entre as moléculas de água e as moléculas de gás.
Existem duas maneiras pelas quais os gases podem se dissolver na água: ligação de van der Waals e ligação de hidrogênio.
Moléculas heteronucleares (isto é, com átomos de elementos diferentes), como NH3 ouCO2, têm uma diferença de eletronegatividade entre os átomos. N e O são mais eletronegativos que H e C, respectivamente. Assim, N e O permanecem parcialmente negativos e H e C tornam-se parcialmente positivos. Isso leva à polarização parcial de NH3moléculas e CO2 .
As extremidades negativas (N e O) são atraídas para o H parcialmente positivo da água; enquanto isso, as extremidades positivas (H e C) são atraídas pelo O parcialmente negativo da água. Isso é ligação de hidrogênio. Quanto maior a polarização da molécula gasosa, melhor ela se dissolve na água.
Moléculas homonucleares (isto é, com átomos do mesmo elemento), como O2e N2, são apolares e pouco solúveis (solubilidade muito baixa) em água. Forças de atração fracas de van der Waals retêm esses gases com moléculas de água. Estas são muito mais fracas do que asinterações dipolo-dipolo .
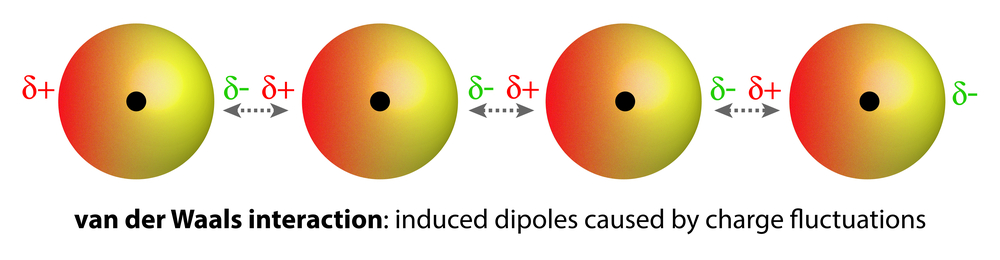
Forças fracas de van der Waals surgem devido a uma mudança na distribuição de elétrons de carga ao redor dos átomos, resultando em uma polarização induzida temporária. (Crédito da foto: magnetix/Shutterstock)
Asolubilidadedos gases na águadiminui à medida que a temperatura aumenta.
A sequência de eventos quando a água ferve
Vamos tomar água líquida em temperatura ambiente (25oC). A esta temperatura, a solubilidade do O2é de 8,27 mg/L e a do CO2é de 1,5 g/L. À medida que a temperatura aumenta, as moléculas de gás e água ganham mais energia cinética. Essa energia torna mais fácil para todas as moléculas superarem a atração intermolecular. A 50oC, a solubilidade do O2diminui para 2,75 mg/L e a do CO2para 0,75 g/L. Essa diminuição na solubilidade significa que as moléculas gasosas podem superar as fracas atrações intermoleculares.Como as moléculas de gás têm densidades menores que a da água, elas sobem para o topo como bolhas. Moléculas homonucleares como N2e O2borbulham em temperaturas mais baixas por causa das forças fracas de van der Waals. Aumentar ainda mais a temperatura resulta no borbulhamento de moléculas polares como CO2e NH3, que são mantidas por interações dipolo-dipolo.

Moléculas de gás borbulhando para fora da água. (Crédito da foto: Egoreichenkov Evgenii/Shutterstock)
Este borbulhar continua até que o ponto de ebulição da água seja alcançado. O aquecimento da água não é completamente uniforme, o que significa que existem regiões de temperaturas mais altas e mais baixas. Em temperaturas acima de 90oC, algumas moléculas de água próximas ao fundo ganham energia suficiente para fazer a transição para a fase de vapor. São formadas regiões de água gasosa, indicadas por enormes bolhas subindo do fundo. Além disso, devido ao movimento vigoroso das moléculas, o aquecimento convectivo aumenta ainda mais a temperatura. A 100o C, quase todas as moléculas de água têm energia cinética suficiente para fazer a transição para a fase de vapor e as bolhas de vapor de água começarão a subir rapidamente!