Por que o ouro é dourado?
Então espere, o que a teoria da relatividade tem a ver com ouro?
Por que os metais são brilhantes?
Mar de elétrons

Mar de elétrons que não pertencem a nenhum átomo de metal isolado
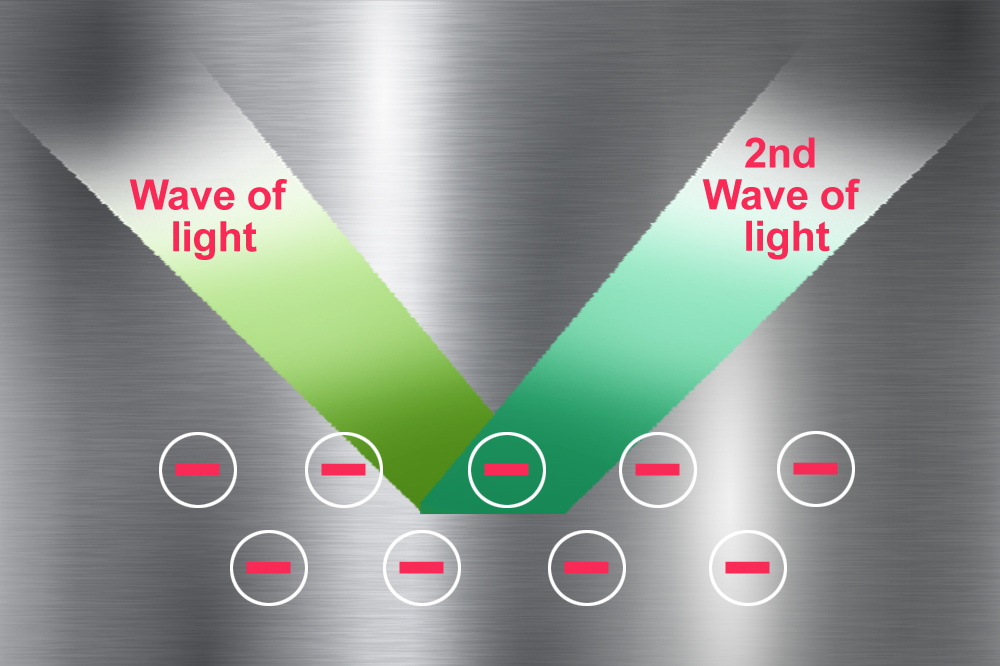
Segunda onda de luz refletida pelo mar de elétrons.

Esferas de metal brilhante (crédito da foto: snappygoat)
A relatividade de Einstein e o átomo de ouro
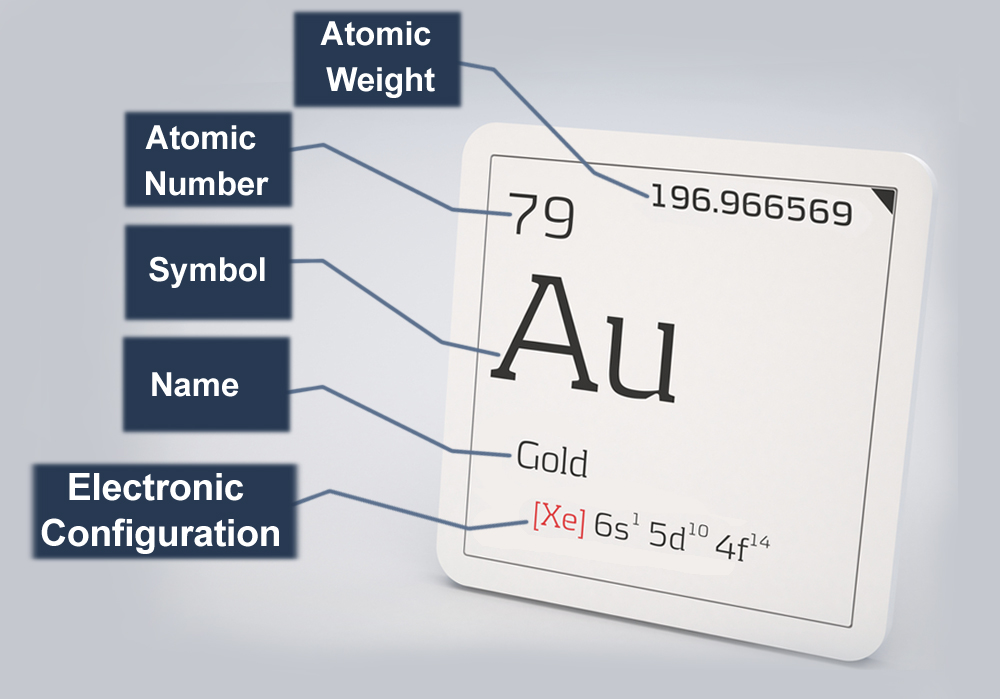
Fatos atômicos
Modelo atômico de Bohr
Raio de Bohr
A dupla dinâmica: relatividade especial e mecânica quântica

Forma diferente de nuvens de elétrons ao redor do núcleo (Crédito da foto: ThreePhaseAC
/ Wikimedia Commons)

Forma do orbital atômico do orbital s (Crédito da foto: Geek3 / Wikimedia Commons)
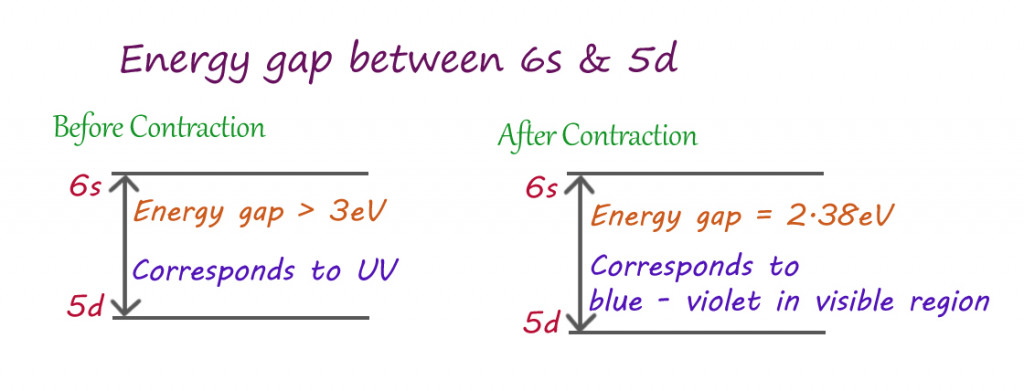
Efeito da contração relativística
Conclusão
O efeito de E = mc 2 no ouro não terminaapenascom seu deslumbramento.Também evita que o ouro reaja com os fatores ambientais, mantendo-o impecável por toda a eternidade.A capacidade do ouro de permitir a entrada de luz visível e refletir os raios ultravioleta e infravermelho o tornou parte integrante do design de trajes espaciais (por exemplo, as viseiras). Também é crítico em componentes de satélites devido à sua grande condutividade elétrica e imunidade à corrosão por UV e raios-X.
Então, da próxima vez que alguém disser “A teoria da relatividade especial não afeta a vida cotidiana”, basta lembrar que ela mantém nossas joias brilhantes e nossos sistemas de GPS funcionando.

Uma fina camada de ouro é revestida nas viseiras dos astronautas (Crédito da foto: MGS / Shutterstock)